Liste des éléments
»
Actinium
»
Argent
»
Argon
»
Arsenic
»
Astate
»
Azote
»
Baryum
»
Bismuth
»
Bohrium
»
Bore
»
Brome
»
Cadmium
»
Calcium
»
Carbone
»
Cérium
»
Césium
»
Chlore
»
Chrome
»
Cobalt
»
Cuivre
»
Curium
»
Dubnium
»
Erbium
»
Etain
»
Europium
»
Fer
»
Fermium
»
Fluor
»
Francium
»
Gallium
»
Hafnium
»
Hassium
»
Hélium
»
Holmium
»
Indium
»
Iode
»
Iridium
»
Krypton
»
Lanthane
»
Lithium
»
Lutécium
»
Mercure
»
Néodyme
»
Néon
»
Nickel
»
Nihonium
»
Niobium
»
Nobélium
»
Or
»
Osmium
»
Oxygène
»
Platine
»
Plomb
»
Polonium
»
Radium
»
Radon
»
Rhénium
»
Rhodium
»
Rubidium
»
Samarium
»
Scandium
»
Sélénium
»
Silicium
»
Sodium
»
Soufre
»
Tantale
»
Tellure
»
Tennesse
»
Terbium
»
Thallium
»
Thorium
»
Thulium
»
Titane
»
Uranium
»
Vanadium
»
Xénon
»
Yttrium
»
Zinc
Ar - Argon - NON MÉTAL GAZ NOBLE
L’argon est un élément chimique de la famille des gaz nobles, de symbole Ar et numéro atomique 18. Il est produit par séparation fractionnée des gaz présents dans l’air, principalement par l’oxygène et l’azote. Il est inodore, incolore et inerte.
L'argon est un gaz inerte à l'état gazeux, qui forme des molécules à huit atomes (Atomes d'Argon – Ar8). Sa masse molaire est de 39,948 g/mol. Ses caractéristiques le rendent très stable dans des environnements aseptiques. C'est le troisième gaz noble le plus abondant dans l'atmosphère, représentant 0,94 % de l'air. Sa température d'ébullition et sa pression de vapeur saturent à – 186 °C et 0,52 MPa respectivement.
L’argon est un mauvais conducteur thermique et électrique, et est par conséquent utilisé pour la soudure et le remplissage de produits électroniques et pour le remplissage des lampes fluorescentes. Il est également utilisé comme gaz protecteur, car il n’est pas combustible et n’ira pas réagir avec d’autres molécules.
L’argon est utilisé dans de nombreuses applications, notamment en métallurgie, pour le remplissage des incendies, pour la fabrication de produits chimiques et d’isolants, pour le remplissage des lampes fluorescentes, et pour l’inertage des récipients pressurisés et des enceintes où des températures élevées sont utilisées. L’argon est également utilisé en analyse gaz chromatographie pour séparer les mélanges et mesurer la concentration des gaz individuels. Enfin, l’argon est utilisé pour la fabrication de médicaments, par exemple l’analgésique lidocaïne.
L'argon est un gaz inerte à l'état gazeux, qui forme des molécules à huit atomes (Atomes d'Argon – Ar8). Sa masse molaire est de 39,948 g/mol. Ses caractéristiques le rendent très stable dans des environnements aseptiques. C'est le troisième gaz noble le plus abondant dans l'atmosphère, représentant 0,94 % de l'air. Sa température d'ébullition et sa pression de vapeur saturent à – 186 °C et 0,52 MPa respectivement.
L’argon est un mauvais conducteur thermique et électrique, et est par conséquent utilisé pour la soudure et le remplissage de produits électroniques et pour le remplissage des lampes fluorescentes. Il est également utilisé comme gaz protecteur, car il n’est pas combustible et n’ira pas réagir avec d’autres molécules.
L’argon est utilisé dans de nombreuses applications, notamment en métallurgie, pour le remplissage des incendies, pour la fabrication de produits chimiques et d’isolants, pour le remplissage des lampes fluorescentes, et pour l’inertage des récipients pressurisés et des enceintes où des températures élevées sont utilisées. L’argon est également utilisé en analyse gaz chromatographie pour séparer les mélanges et mesurer la concentration des gaz individuels. Enfin, l’argon est utilisé pour la fabrication de médicaments, par exemple l’analgésique lidocaïne.
Synthétique
Radioactif
Liquide
Gazeux
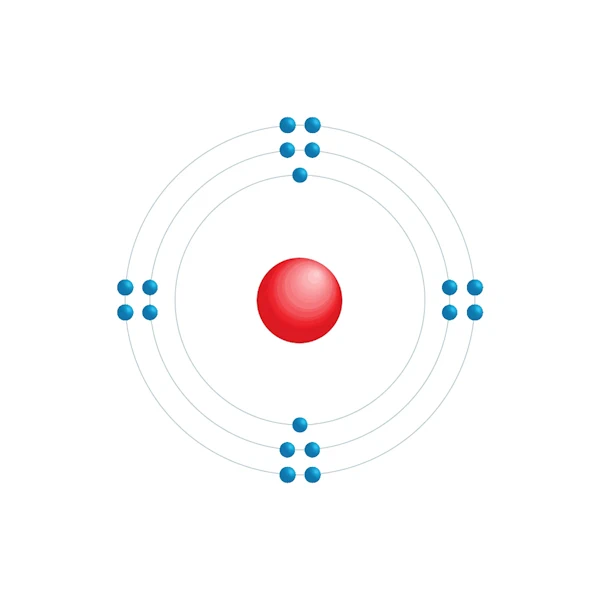
Diagramme de configuration électronique
| Nom | Argon |
| Numéro atomique | 18 |
| Masse atomique | 39.948 |
| Symbole | Ar |
| Point de fusion | -189.4 |
| Point d'ébullition | -185.9 |
| Densité | 0.0017837 |
| Période | 3 |
| Groupe | 18 |
| Découverte | 1894 Rayleigh and Ramsay |
| Abondance | 3.5 |
| Radius | 0.88 |
| Electronégativité | 0 |
| Ionisation | 15.7596 |
| Nombre d'isotope | 8 |
| Configuration électronqiue | [Ne] 3s2 3p6 |
| Etats d'oxydation | 0 |
| Electron par niveau d'énergie | 2,8,8 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se