Liste des éléments
»
Actinium
»
Argent
»
Argon
»
Arsenic
»
Astate
»
Azote
»
Baryum
»
Bismuth
»
Bohrium
»
Bore
»
Brome
»
Cadmium
»
Calcium
»
Carbone
»
Cérium
»
Césium
»
Chlore
»
Chrome
»
Cobalt
»
Cuivre
»
Curium
»
Dubnium
»
Erbium
»
Etain
»
Europium
»
Fer
»
Fermium
»
Fluor
»
Francium
»
Gallium
»
Hafnium
»
Hassium
»
Hélium
»
Holmium
»
Indium
»
Iode
»
Iridium
»
Krypton
»
Lanthane
»
Lithium
»
Lutécium
»
Mercure
»
Néodyme
»
Néon
»
Nickel
»
Nihonium
»
Niobium
»
Nobélium
»
Or
»
Osmium
»
Oxygène
»
Platine
»
Plomb
»
Polonium
»
Radium
»
Radon
»
Rhénium
»
Rhodium
»
Rubidium
»
Samarium
»
Scandium
»
Sélénium
»
Silicium
»
Sodium
»
Soufre
»
Tantale
»
Tellure
»
Tennesse
»
Terbium
»
Thallium
»
Thorium
»
Thulium
»
Titane
»
Uranium
»
Vanadium
»
Xénon
»
Yttrium
»
Zinc
minéralogie
élements
Fr Francium
Fr - Francium - MÉTAL ALCALIN
Le francium est un élément chimique de numéro atomique 87 et de symbole Fr. Il est placé dans le groupe des alcalins et appartient à la famille des actinides. Il est considéré comme l'élément le plus rare sur Terre et ne peut être trouvé que dans des quantités très faibles, et ce uniquement dans des sites radioactifs et des centres de recherche disposant de technologies très avancées.
Le francium est un métal très mou et non toxique. C'est un alcalin qui réagit fortement avec les acides, produisant des ions hydroxyle. Son point de fusion est très bas et il se transforme rapidement en un gaz inodore et incolore lorsqu'il est chauffé.
Le francium ne présente aucune application commerciale connue, car c'est l'élément le plus radioactif de tous les éléments connus. Il est utilisé principalement pour ses propriétés radioactives, qui sont utilisées en recherche scientifique. Il est également utilisé pour la production de radiopharmaceutiques, pour les expériences nucléaires et pour l'étude des isotopes. Par ailleurs, le francium est aussi utilisé dans la recherche médicale, surtout pour le traitement de certaines maladies, telles que le cancer et les maladies cardiovasculaires.
Le francium est un métal très mou et non toxique. C'est un alcalin qui réagit fortement avec les acides, produisant des ions hydroxyle. Son point de fusion est très bas et il se transforme rapidement en un gaz inodore et incolore lorsqu'il est chauffé.
Le francium ne présente aucune application commerciale connue, car c'est l'élément le plus radioactif de tous les éléments connus. Il est utilisé principalement pour ses propriétés radioactives, qui sont utilisées en recherche scientifique. Il est également utilisé pour la production de radiopharmaceutiques, pour les expériences nucléaires et pour l'étude des isotopes. Par ailleurs, le francium est aussi utilisé dans la recherche médicale, surtout pour le traitement de certaines maladies, telles que le cancer et les maladies cardiovasculaires.
Synthétique
Radioactif
Liquide
Gazeux
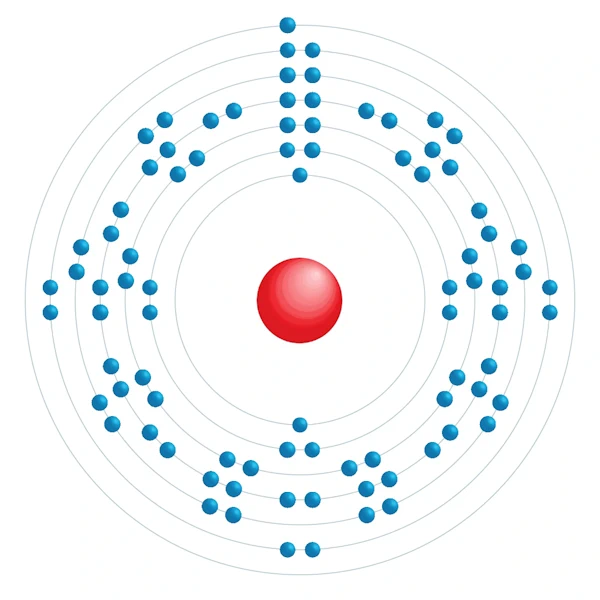
Diagramme de configuration électronique
| Nom | Francium |
| Numéro atomique | 87 |
| Masse atomique | 223 |
| Symbole | Fr |
| Point de fusion | 26.85 |
| Point d'ébullition | 677 |
| Densité | 1.87 |
| Période | 7 |
| Groupe | 1 |
| Découverte | 1939 Perey |
| Abondance | 0.001 |
| Radius | 0 |
| Electronégativité | 0.7 |
| Ionisation | 4.0727 |
| Nombre d'isotope | 21 |
| Configuration électronqiue | [Rn] 7s1 |
| Etats d'oxydation | 1 |
| Electron par niveau d'énergie | 2,8,18,32,18,8,1 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se