Liste des éléments
»
Actinium
»
Argent
»
Argon
»
Arsenic
»
Astate
»
Azote
»
Baryum
»
Bismuth
»
Bohrium
»
Bore
»
Brome
»
Cadmium
»
Calcium
»
Carbone
»
Cérium
»
Césium
»
Chlore
»
Chrome
»
Cobalt
»
Cuivre
»
Curium
»
Dubnium
»
Erbium
»
Etain
»
Europium
»
Fer
»
Fermium
»
Fluor
»
Francium
»
Gallium
»
Hafnium
»
Hassium
»
Hélium
»
Holmium
»
Indium
»
Iode
»
Iridium
»
Krypton
»
Lanthane
»
Lithium
»
Lutécium
»
Mercure
»
Néodyme
»
Néon
»
Nickel
»
Nihonium
»
Niobium
»
Nobélium
»
Or
»
Osmium
»
Oxygène
»
Platine
»
Plomb
»
Polonium
»
Radium
»
Radon
»
Rhénium
»
Rhodium
»
Rubidium
»
Samarium
»
Scandium
»
Sélénium
»
Silicium
»
Sodium
»
Soufre
»
Tantale
»
Tellure
»
Tennesse
»
Terbium
»
Thallium
»
Thorium
»
Thulium
»
Titane
»
Uranium
»
Vanadium
»
Xénon
»
Yttrium
»
Zinc
minéralogie
élements
Sg Seaborgium
Sg - Seaborgium - MÉTAL DE TRANSITION
Le seaborgium est un élément chimique synthétique dont le symbole est «Sg». Il a été créé en 1974 par une équipe de chercheurs dirigée par le chimiste américain Glenn T. Seaborg. C'est un métal de transition artificiel à demi-vie très courte qui n'existe que dans les laboratoires et les centres de recherche. Le seaborgium n'est pas naturellement présent dans l'environnement.
Le seaborgium a le numéro atomique 106 et le numéro de masse 266. Il a une densité approximative de 23,2 g/cm3 et un point de fusion estimé à 1400 °C. Il est classé comme un métal de transition du groupe 6 du tableau périodique des éléments.
Le seaborgium a des propriétés chimiques assez similaires à celles du plutonium et du curium. Il réagit facilement avec l'oxygène, l'azote et l'hydrogène pour former des composés seaborgium-oxyde, seaborgium-azote et seaborgium-hydrure. Il peut également former des sels comme les chlorures, bromures et iodures.
Le seaborgium est principalement utilisé dans la recherche scientifique et la recherche médicale. Les organismes de recherche et les laboratoires utilisent le seaborgium pour étudier les propriétés des autres éléments chimiques et leurs applications pratiques. De plus, le seaborgium est utilisé pour étudier le comportement des radioéléments et l'abondance des isotopes. Il est également étudié pour en savoir plus sur l'évolution atomique et l'énergie nucléaire.
Le seaborgium a le numéro atomique 106 et le numéro de masse 266. Il a une densité approximative de 23,2 g/cm3 et un point de fusion estimé à 1400 °C. Il est classé comme un métal de transition du groupe 6 du tableau périodique des éléments.
Le seaborgium a des propriétés chimiques assez similaires à celles du plutonium et du curium. Il réagit facilement avec l'oxygène, l'azote et l'hydrogène pour former des composés seaborgium-oxyde, seaborgium-azote et seaborgium-hydrure. Il peut également former des sels comme les chlorures, bromures et iodures.
Le seaborgium est principalement utilisé dans la recherche scientifique et la recherche médicale. Les organismes de recherche et les laboratoires utilisent le seaborgium pour étudier les propriétés des autres éléments chimiques et leurs applications pratiques. De plus, le seaborgium est utilisé pour étudier le comportement des radioéléments et l'abondance des isotopes. Il est également étudié pour en savoir plus sur l'évolution atomique et l'énergie nucléaire.
Synthétique
Radioactif
Liquide
Gazeux
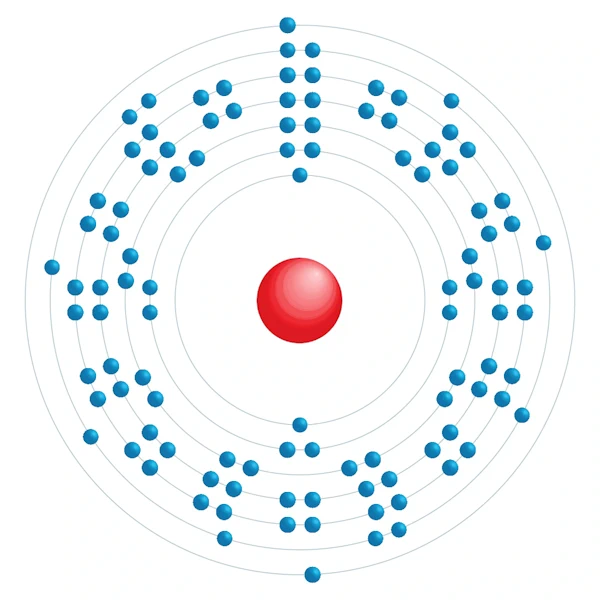
Diagramme de configuration électronique
| Nom | Seaborgium |
| Numéro atomique | 106 |
| Masse atomique | 269 |
| Symbole | Sg |
| Point de fusion | 0 |
| Point d'ébullition | 0 |
| Densité | 35 |
| Période | 7 |
| Groupe | 6 |
| Découverte | 1974 Ghiorso et al. |
| Abondance | 0 |
| Radius | 0 |
| Electronégativité | 0 |
| Ionisation | 0 |
| Nombre d'isotope | 0 |
| Configuration électronqiue | [Rn] 5f14 6d4 7s2 |
| Etats d'oxydation | 0 |
| Electron par niveau d'énergie | 2,8,18,32,32,12,2 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se