Liste des éléments
»
Actinium
»
Argent
»
Argon
»
Arsenic
»
Astate
»
Azote
»
Baryum
»
Bismuth
»
Bohrium
»
Bore
»
Brome
»
Cadmium
»
Calcium
»
Carbone
»
Cérium
»
Césium
»
Chlore
»
Chrome
»
Cobalt
»
Cuivre
»
Curium
»
Dubnium
»
Erbium
»
Etain
»
Europium
»
Fer
»
Fermium
»
Fluor
»
Francium
»
Gallium
»
Hafnium
»
Hassium
»
Hélium
»
Holmium
»
Indium
»
Iode
»
Iridium
»
Krypton
»
Lanthane
»
Lithium
»
Lutécium
»
Mercure
»
Néodyme
»
Néon
»
Nickel
»
Nihonium
»
Niobium
»
Nobélium
»
Or
»
Osmium
»
Oxygène
»
Platine
»
Plomb
»
Polonium
»
Radium
»
Radon
»
Rhénium
»
Rhodium
»
Rubidium
»
Samarium
»
Scandium
»
Sélénium
»
Silicium
»
Sodium
»
Soufre
»
Tantale
»
Tellure
»
Tennesse
»
Terbium
»
Thallium
»
Thorium
»
Thulium
»
Titane
»
Uranium
»
Vanadium
»
Xénon
»
Yttrium
»
Zinc
minéralogie
élements
No Nobélium
No - Nobélium - MÉTAL ACTINIDES
Le nobelium est un élément chimique radioactif du groupe des actinides de numéro atomique 102. Son corps simple est le nobelium-256 et son isotope le plus stable est le nobelium-254. Le nobelium est un métal dense et mou, blanc argenté. Il a une masse atomique relative de 259 g/mol.
Le nobelium a été identifié en 1958 dans des réactions nucléaires à la fois naturelles et artificielles et est le plus léger des éléments connus de la série actinide. Il est très rare et ne se trouve pas à l'état naturel. Les seuls endroits où il se trouve sont les laboratoires de physique nucléaire. Bien que le nobelium ne soit pas utilisé dans une quantité importante, il est considéré comme l'un des plus intéressants et des plus fascinants des éléments radioactifs.
Le nobelium est très instable et se décompose rapidement en produisant des rayonnements gamma, neutrons et alpha. Ces radiations sont très dangereuses et peuvent causer des dommages à la santé et à l'environnement. Par conséquent, le nobelium est généralement manipulé avec des gants, des vêtements et des masques de protection à l'utilisation.
Le nobelium a été utilisé dans des recherches sur l'ensemble des actinides. Il a été utilisé pour étudier la stabilité et la prédiction des isotopes, ainsi que pour étudier les propriétés nucléaires et la réaction nucléaire. Il est également utilisé dans les recherches pour trouver des moyens de produire de l'énergie à partir de sources radioactives, en particulier celles qui sont utilisées dans l'industrie nucléaire.
Le nobelium a été identifié en 1958 dans des réactions nucléaires à la fois naturelles et artificielles et est le plus léger des éléments connus de la série actinide. Il est très rare et ne se trouve pas à l'état naturel. Les seuls endroits où il se trouve sont les laboratoires de physique nucléaire. Bien que le nobelium ne soit pas utilisé dans une quantité importante, il est considéré comme l'un des plus intéressants et des plus fascinants des éléments radioactifs.
Le nobelium est très instable et se décompose rapidement en produisant des rayonnements gamma, neutrons et alpha. Ces radiations sont très dangereuses et peuvent causer des dommages à la santé et à l'environnement. Par conséquent, le nobelium est généralement manipulé avec des gants, des vêtements et des masques de protection à l'utilisation.
Le nobelium a été utilisé dans des recherches sur l'ensemble des actinides. Il a été utilisé pour étudier la stabilité et la prédiction des isotopes, ainsi que pour étudier les propriétés nucléaires et la réaction nucléaire. Il est également utilisé dans les recherches pour trouver des moyens de produire de l'énergie à partir de sources radioactives, en particulier celles qui sont utilisées dans l'industrie nucléaire.
Synthétique
Radioactif
Liquide
Gazeux
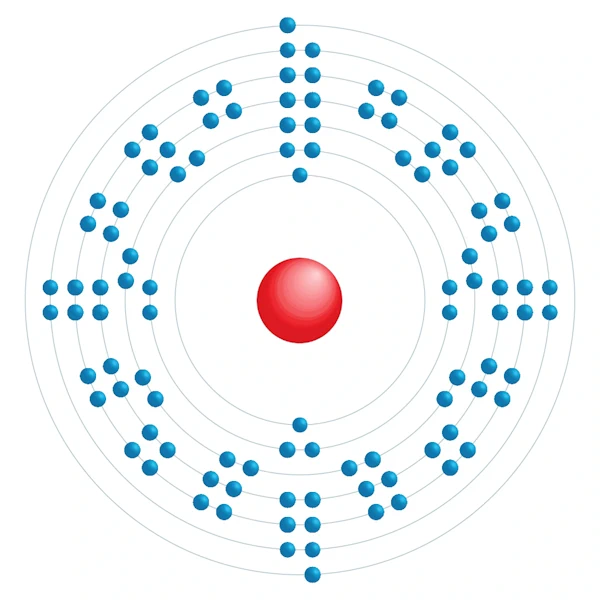
Diagramme de configuration électronique
| Nom | Nobélium |
| Numéro atomique | 102 |
| Masse atomique | 259 |
| Symbole | No |
| Point de fusion | 827 |
| Point d'ébullition | 0 |
| Densité | 9.9 |
| Période | 7 |
| Groupe | 0 |
| Découverte | 1958 Ghiorso et al. |
| Abondance | 0 |
| Radius | 0 |
| Electronégativité | 1.3 |
| Ionisation | 6.65 |
| Nombre d'isotope | 73 |
| Configuration électronqiue | [Rn] 5f14 7s2 |
| Etats d'oxydation | 2,3 |
| Electron par niveau d'énergie | 2,8,18,32,32,8,2 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se