Liste des éléments
»
Actinium
»
Argent
»
Argon
»
Arsenic
»
Astate
»
Azote
»
Baryum
»
Bismuth
»
Bohrium
»
Bore
»
Brome
»
Cadmium
»
Calcium
»
Carbone
»
Cérium
»
Césium
»
Chlore
»
Chrome
»
Cobalt
»
Cuivre
»
Curium
»
Dubnium
»
Erbium
»
Etain
»
Europium
»
Fer
»
Fermium
»
Fluor
»
Francium
»
Gallium
»
Hafnium
»
Hassium
»
Hélium
»
Holmium
»
Indium
»
Iode
»
Iridium
»
Krypton
»
Lanthane
»
Lithium
»
Lutécium
»
Mercure
»
Néodyme
»
Néon
»
Nickel
»
Nihonium
»
Niobium
»
Nobélium
»
Or
»
Osmium
»
Oxygène
»
Platine
»
Plomb
»
Polonium
»
Radium
»
Radon
»
Rhénium
»
Rhodium
»
Rubidium
»
Samarium
»
Scandium
»
Sélénium
»
Silicium
»
Sodium
»
Soufre
»
Tantale
»
Tellure
»
Tennesse
»
Terbium
»
Thallium
»
Thorium
»
Thulium
»
Titane
»
Uranium
»
Vanadium
»
Xénon
»
Yttrium
»
Zinc
Na - Sodium - MÉTAL ALCALIN
Le sodium est un élément chimique de la famille des métaux alcalins qui porte le symbole chimique Na. Il est l'élément fondamental le plus abondant dans les océans et est l'un des éléments les plus abondants sur Terre.
Le sodium pur est un métal mou, blanc argenté. Il est découvert par Sir Humphrey Davy en 1807. Il est très réactif, et réagit très facilement avec l'eau pour former un hydroxyde d'hydrogène et sodium.
Le sodium est largement utilisé dans l'industrie alimentaire, étant utilisé pour saler les aliments. Il est également largement utilisé dans l'industrie chimique et pour fabriquer des produits à base de sel. Le sodium est également utilisé dans l'industrie de l'aluminium pour produire de l'aluminium.
Les caractéristiques principales du sodium sont sa faible densité et sa faible conductivité thermique et électrique. Cela signifie qu'il est un excellent isolant thermique et électrique. Il a également une faible tension de vapeur et est très soluble dans l'eau.
Les propriétés chimiques du sodium sont principalement dues à sa haute réactivité. Le sodium est très réactif avec l'eau, l'oxygène, l'acide sulfurique et d'autres substances. Les produits de réaction avec l'oxygène sont des oxydes, tandis que ceux avec l'eau sont des hydroxyde et des carbonates.
Le sodium est utilisé dans de nombreuses applications industrielles, car il est très réactif et abondant. Certains des usages courants comprennent la fabrication de sels et l'utilisation comme catalyseur dans certaines réactions chimiques. Il est également utilisé dans l'industrie alimentaire pour conserver les aliments et améliorer leur goût. Il est également utilisé pour la production d'aluminium et pour le traitement des eaux usées.
Le sodium pur est un métal mou, blanc argenté. Il est découvert par Sir Humphrey Davy en 1807. Il est très réactif, et réagit très facilement avec l'eau pour former un hydroxyde d'hydrogène et sodium.
Le sodium est largement utilisé dans l'industrie alimentaire, étant utilisé pour saler les aliments. Il est également largement utilisé dans l'industrie chimique et pour fabriquer des produits à base de sel. Le sodium est également utilisé dans l'industrie de l'aluminium pour produire de l'aluminium.
Les caractéristiques principales du sodium sont sa faible densité et sa faible conductivité thermique et électrique. Cela signifie qu'il est un excellent isolant thermique et électrique. Il a également une faible tension de vapeur et est très soluble dans l'eau.
Les propriétés chimiques du sodium sont principalement dues à sa haute réactivité. Le sodium est très réactif avec l'eau, l'oxygène, l'acide sulfurique et d'autres substances. Les produits de réaction avec l'oxygène sont des oxydes, tandis que ceux avec l'eau sont des hydroxyde et des carbonates.
Le sodium est utilisé dans de nombreuses applications industrielles, car il est très réactif et abondant. Certains des usages courants comprennent la fabrication de sels et l'utilisation comme catalyseur dans certaines réactions chimiques. Il est également utilisé dans l'industrie alimentaire pour conserver les aliments et améliorer leur goût. Il est également utilisé pour la production d'aluminium et pour le traitement des eaux usées.
Synthétique
Radioactif
Liquide
Gazeux
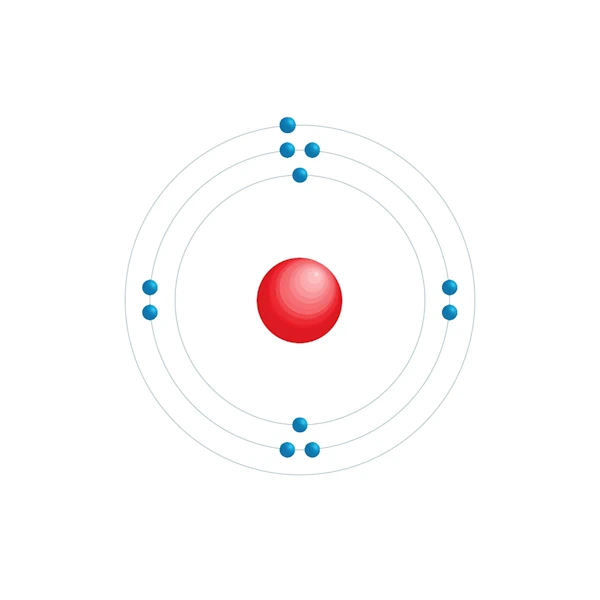
Diagramme de configuration électronique
| Nom | Sodium |
| Numéro atomique | 11 |
| Masse atomique | 22.98976928 |
| Symbole | Na |
| Point de fusion | 97.8 |
| Point d'ébullition | 892 |
| Densité | 0.971 |
| Période | 3 |
| Groupe | 1 |
| Découverte | 1807 Davy |
| Abondance | 23600 |
| Radius | 2.2 |
| Electronégativité | 0.93 |
| Ionisation | 5.1391 |
| Nombre d'isotope | 7 |
| Configuration électronqiue | [Ne] 3s1 |
| Etats d'oxydation | -1,1 |
| Electron par niveau d'énergie | 2,8,1 |
| Minéral | Dureté | Densité |
| Abenakiite-(Ce) | 4.00 / 4.00 | 3.21 |
| Acmonidesite | ||
| Actinolite | 5.50 / 5.50 | 2.98 |
| Adamsite-(Y) | 3.00 / 3.00 | |
| Adranosite | ||
| Adranosite-(Fe) | 2.20 | |
| Aegirine | 6.00 / 6.50 | 3.50 |
| Aegirine-augite | 6.00 / 6.00 | 3.40 |
| Aenigmatite | 5.00 / 6.00 | 3.74 |
| Aerinite | 3.00 / 3.00 | 2.48 |
| Afghanite | 5.50 / 6.00 | 2.55 |
| Agrellite | 5.50 / 5.50 | 2.88 |
| Aiolosite | 3.59 | |
| Ajoite | 2.96 | |
| Albite | 7.00 / 7.00 | 2.61 |
| Alexkhomyakovite | ||
| Alflarsenite | 4.00 / 4.00 | 2.61 |
| Aliettite | 1.00 / 2.00 | |
| Alloriite | 5.00 / 5.00 | 2.35 |
| Alluaivite | 5.00 / 6.00 | 2.76 |
| Alluaudite | 5.00 / 5.50 | 3.45 |
| Almarudite | 6.00 / 6.00 | 2.71 |
| Alnaperbøeite-(Ce) | ||
| Alsakharovite-Zn | 5.00 / 5.00 | 2.90 |
| Altisite | 6.00 / 6.00 | 2.64 |
| Alum-(Na) | 3.00 / 3.00 | 1.67 |
| Alumino-ferrobarroisite | ||
| Alumino-ferrowinchite | ||
| Alumino-magnesiotaramite | ||
| Alumino-ottoliniite | ||
| Aluminobarroisite | 5.00 / 6.00 | 2.94 |
| Aluminokatophorite | 5.00 / 6.00 | |
| Aluminowinchite | ||
| Alumoåkermanite | 4.00 / 5.00 | 3.00 |
| Amarillite | 2.50 / 3.00 | 2.19 |
| Amblygonite | 5.50 / 6.00 | 2.98 |
| Ameghinite | 2.00 / 3.00 | 2.02 |
| Amicite | 5.00 / 5.50 | 2.06 |
| Analcime | 5.00 / 5.00 | 2.30 |
| Andersonite | 2.50 / 2.50 | 2.79 |
| Andesine | 7.00 / 7.00 | 2.66 |
| Andrianovite | 5.00 / 5.00 | 3.02 |
| Angarfite | 2.50 / 2.50 | 2.77 |
| Anorthite | 6.00 / 6.00 | 2.72 |
| Anorthoclase | 6.00 / 6.00 | 2.57 |
| Antipinite | 2.00 / 2.00 | 2.55 |
| Apexite | 2.00 / 2.00 | 1.74 |
| Aphthitalite | 3.00 / 3.00 | 2.70 |
| Aqualite | 4.00 / 5.00 | 2.66 |
| Arapovite | 5.50 / 6.00 | 3.43 |
| Arctite | 5.00 / 5.00 | 3.11 |
| Ardennite-(V) | 6.00 / 7.00 | 3.55 |
| Arfvedsonite | 5.50 / 6.00 | 3.44 |
| Arisite-(Ce) | ||
| Arisite-(La) | 3.00 / 3.50 | 4.07 |
| Aristarainite | 3.50 / 3.50 | 2.03 |
| Armbrusterite | 3.50 / 3.50 | 2.78 |
| Arnhemite | 2.33 | |
| Arrojadite-(BaFe) | 3.54 | |
| Arrojadite-(BaNa) | ||
| Arrojadite-(KFe) | 5.00 / 5.00 | 3.50 |
| Arrojadite-(KNa) | ||
| Arrojadite-(NaFe) | ||
| Arrojadite-(PbFe) | 4.00 / 5.00 | |
| Arrojadite-(SrFe) | ||
| Arseniopleite | 3.50 / 3.50 | 4.22 |
| Arsmirandite | ||
| Ashcroftine-(Y) | 5.00 / 5.00 | 2.61 |
| Aspidolite | 2.00 / 3.00 | 2.89 |
| Astrophyllite | 3.00 / 3.50 | 3.30 |
| Augite | 5.00 / 6.50 | 3.20 |
| Bakhchisaraitsevite | 2.00 / 2.50 | 2.50 |
| Balliranoite | ||
| Banalsite | 6.00 / 6.00 | 3.07 |
| Bannermanite | 3.50 | |
| Bannisterite | 4.00 / 4.00 | 2.83 |
| Barahonaite-(Al) | ||
| Barahonaite-(Fe) | 3.03 | |
| Barentsite | 3.00 / 3.00 | 2.56 |
| Bario-olgite | 4.00 / 4.50 | 4.00 |
| Barnesite | 3.00 / 3.00 | 3.15 |
| Barrerite | 3.00 / 4.00 | 2.13 |
| Barroisite | 5.00 / 6.00 | 3.00 |
| Barrydawsonite-(Y) | ||
| Barytolamprophyllite | 2.00 / 3.00 | 3.62 |
| Batiferrite | 6.00 / 6.00 | |
| Batisite | 5.90 / 5.90 | 3.43 |
| Bazzite | 6.50 / 6.50 | 2.80 |
| Bederite | 5.00 / 5.00 | 3.48 |
| Beidellite | 1.00 / 2.00 | 2.00 |
| Belakovskiite | ||
| Bellbergite | 5.00 / 5.00 | 2.20 |
| Belovite-(Ce) | 5.00 / 5.00 | 4.19 |
| Belovite-(La) | 5.00 / 5.00 | 4.19 |
| Benyacarite | 2.50 / 3.00 | 2.40 |
| Beryllonite | 5.50 / 6.00 | 2.80 |
| Berzeliite | 4.50 / 5.00 | 4.08 |
| Betalomonosovite | ||
| Betpakdalite-NaCa | 2.89 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se