Liste des éléments
»
Actinium
»
Argent
»
Argon
»
Arsenic
»
Astate
»
Azote
»
Baryum
»
Bismuth
»
Bohrium
»
Bore
»
Brome
»
Cadmium
»
Calcium
»
Carbone
»
Cérium
»
Césium
»
Chlore
»
Chrome
»
Cobalt
»
Cuivre
»
Curium
»
Dubnium
»
Erbium
»
Etain
»
Europium
»
Fer
»
Fermium
»
Fluor
»
Francium
»
Gallium
»
Hafnium
»
Hassium
»
Hélium
»
Holmium
»
Indium
»
Iode
»
Iridium
»
Krypton
»
Lanthane
»
Lithium
»
Lutécium
»
Mercure
»
Néodyme
»
Néon
»
Nickel
»
Nihonium
»
Niobium
»
Nobélium
»
Or
»
Osmium
»
Oxygène
»
Platine
»
Plomb
»
Polonium
»
Radium
»
Radon
»
Rhénium
»
Rhodium
»
Rubidium
»
Samarium
»
Scandium
»
Sélénium
»
Silicium
»
Sodium
»
Soufre
»
Tantale
»
Tellure
»
Tennesse
»
Terbium
»
Thallium
»
Thorium
»
Thulium
»
Titane
»
Uranium
»
Vanadium
»
Xénon
»
Yttrium
»
Zinc
O - Oxygène - AUTRE NON MÉTAL
L’oxygène (symbole chimique O) est un élément chimique de la famille des chalcogènes, sous groupe 16 du tableau périodique des éléments. Il est le composant majoritaire de l’atmosphère terrestre, représentant environ 20,9 % du volume total.
L'oxygène est un composé très réactif donc très important pour de nombreuses réactions chimiques. Il est le 3ème élément le plus abondant de l'univers après l'hydrogène et l'hélium. Il est capable de former des liaisons covalentes avec d'autres atomes et peut se combiner avec eux pour former des molécules plus complexes tels que les composés organiques. L’oxygène est un gaz à l'état normal, c'est un gaz incolore, inodore et insipide. Sa formule chimique est O2 et sa masse molaire est de 32 g/mol.
L'oxygène est un gaz très réactif puisqu'il possède huit électrons dans sa couche d'électrons externe. Il est un oxydant puissant et est très utile dans diverses réactions chimiques. Il est également très soluble dans l'eau et est la principale source d'oxygène disponible pour les êtres vivants. L'oxygène est également combustible et est fortement utilisé dans les industries et les laboratoires pour ses propriétés oxydantes.
L'oxygène est le principal composant des combustibles fossiles et est donc très important dans le processus de combustion. Il est largement utilisé pour diverses applications industrielles, notamment dans la fabrication de métaux, de produits chimiques, d'engrais, de médicaments et de produits pharmaceutiques. En plus des usages industriels, l'oxygène est utilisé dans le traitement médical pour aider les personnes souffrant de maladies respiratoires graves. Il est également utilisé par de nombreuses industries telles que l'aéronautique, l'astronautique et les sports extrêmes.
L'oxygène est un composé très réactif donc très important pour de nombreuses réactions chimiques. Il est le 3ème élément le plus abondant de l'univers après l'hydrogène et l'hélium. Il est capable de former des liaisons covalentes avec d'autres atomes et peut se combiner avec eux pour former des molécules plus complexes tels que les composés organiques. L’oxygène est un gaz à l'état normal, c'est un gaz incolore, inodore et insipide. Sa formule chimique est O2 et sa masse molaire est de 32 g/mol.
L'oxygène est un gaz très réactif puisqu'il possède huit électrons dans sa couche d'électrons externe. Il est un oxydant puissant et est très utile dans diverses réactions chimiques. Il est également très soluble dans l'eau et est la principale source d'oxygène disponible pour les êtres vivants. L'oxygène est également combustible et est fortement utilisé dans les industries et les laboratoires pour ses propriétés oxydantes.
L'oxygène est le principal composant des combustibles fossiles et est donc très important dans le processus de combustion. Il est largement utilisé pour diverses applications industrielles, notamment dans la fabrication de métaux, de produits chimiques, d'engrais, de médicaments et de produits pharmaceutiques. En plus des usages industriels, l'oxygène est utilisé dans le traitement médical pour aider les personnes souffrant de maladies respiratoires graves. Il est également utilisé par de nombreuses industries telles que l'aéronautique, l'astronautique et les sports extrêmes.
Synthétique
Radioactif
Liquide
Gazeux
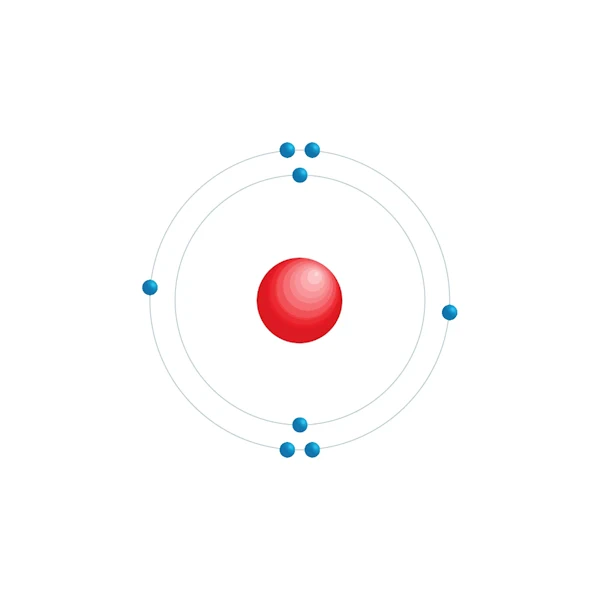
Diagramme de configuration électronique
| Nom | Oxygène |
| Numéro atomique | 8 |
| Masse atomique | 15.9992 |
| Symbole | O |
| Point de fusion | -218.4 |
| Point d'ébullition | -182.9 |
| Densité | 0.001429 |
| Période | 2 |
| Groupe | 16 |
| Découverte | 1774 Priestley/Scheele |
| Abondance | 461000 |
| Radius | 0.65 |
| Electronégativité | 3.44 |
| Ionisation | 13.6181 |
| Nombre d'isotope | 8 |
| Configuration électronqiue | [He] 2s2 2p4 |
| Etats d'oxydation | -2,-1,1,2 |
| Electron par niveau d'énergie | 2,6 |
| Minéral | Dureté | Densité |
| Abenakiite-(Ce) | 4.00 / 4.00 | 3.21 |
| Abernathyite | 2.00 / 3.00 | 3.31 |
| Abhurite | 2.00 / 2.00 | 4.29 |
| Abswurmbachite | 6.50 / 6.50 | 4.96 |
| Abuite | ||
| Acetamide | 1.00 / 1.50 | 1.17 |
| Achalaite | ||
| Acmonidesite | ||
| Actinolite | 5.50 / 5.50 | 2.98 |
| Acuminite | 3.50 / 3.50 | 3.30 |
| Adachiite | ||
| Adamite | 3.50 / 3.50 | 4.30 |
| Adamsite-(Y) | 3.00 / 3.00 | |
| Addibischoffite | ||
| Adelite | 5.00 / 5.00 | 3.73 |
| Admontite | 2.00 / 3.00 | 1.82 |
| Adolfpateraite | 2.00 / 2.00 | 4.24 |
| Adranosite | ||
| Adranosite-(Fe) | 2.20 | |
| Adrianite | ||
| Aegirine | 6.00 / 6.50 | 3.50 |
| Aegirine-augite | 6.00 / 6.00 | 3.40 |
| Aenigmatite | 5.00 / 6.00 | 3.74 |
| Aerinite | 3.00 / 3.00 | 2.48 |
| Aerugite | 4.00 / 4.00 | 5.85 |
| Aeschynite-(Ce) | 5.00 / 6.00 | 5.19 |
| Aeschynite-(Nd) | 5.00 / 6.00 | 4.60 |
| Aeschynite-(Y) | 5.00 / 6.00 | 4.85 |
| Afghanite | 5.50 / 6.00 | 2.55 |
| Afmite | ||
| Afwillite | 3.00 / 3.00 | 2.62 |
| Agaite | 6.99 | |
| Agakhanovite-(Y) | 6.00 / 6.00 | 2.67 |
| Agardite-(Ce) | 3.00 / 3.00 | 3.72 |
| Agardite-(La) | 3.00 / 4.00 | 3.72 |
| Agardite-(Nd) | 3.00 / 4.00 | 3.72 |
| Agardite-(Y) | 3.00 / 4.00 | 3.66 |
| Agate | 6.50 / 7.00 | 2.60 |
| Agate mousse | 6.00 / 6.50 | 2.60 |
| Agrellite | 5.50 / 5.50 | 2.88 |
| Agricolaite | 4.00 / 4.00 | 3.53 |
| Agrinierite | 5.62 | |
| Aheylite | 5.00 / 6.00 | 2.85 |
| Ahlfeldite | 2.00 / 2.50 | 3.37 |
| Ahrensite | 4.14 | |
| Aigue Marine | 7.50 / 8.00 | 2.70 |
| Aiolosite | 3.59 | |
| Ajoite | 2.96 | |
| Akaganeite | 3.00 | |
| Akaogiite | ||
| Akatoreite | 6.00 / 6.00 | 3.48 |
| Akdalaite | 7.00 / 7.00 | 3.68 |
| Akermanite | 5.00 / 6.00 | 2.94 |
| Akhtenskite | 4.00 | |
| Akimotoite | ||
| Aklimaite | ||
| Akrochordite | 3.50 / 3.50 | 3.19 |
| Aksaite | 2.50 / 2.50 | 1.99 |
| Alamosite | 4.50 / 4.50 | 6.49 |
| Alarsite | 3.00 / 3.00 | 3.32 |
| Albertiniite | 2.46 | |
| Albite | 7.00 / 7.00 | 2.61 |
| Albrechtschraufite | 2.00 / 3.00 | 2.60 |
| Alcaparrosaite | 4.00 / 4.00 | 2.81 |
| Aldermanite | 2.00 / 2.00 | 2.00 |
| Aldridgeite | 3.00 / 3.00 | 3.33 |
| Aleksandrovite | 4.00 / 4.50 | 3.07 |
| Alexkhomyakovite | ||
| Alflarsenite | 4.00 / 4.00 | 2.61 |
| Alforsite | 5.00 / 5.00 | 4.73 |
| Alfredopetrovite | 2.50 / 2.50 | 2.50 |
| Alfredstelznerite | ||
| Aliettite | 1.00 / 2.00 | |
| Allactite | 4.50 / 4.50 | 3.00 |
| Allanite | 5.50 / 5.50 | 3.30 |
| Allanite-(La) | 6.00 / 6.00 | 3.93 |
| Allanite-(Nd) | ||
| Allanite-(Y) | 5.50 / 5.50 | 3.30 |
| Allanpringite | 3.00 / 3.00 | 2.54 |
| Alleghanyite | 6.00 / 5.00 | 4.00 |
| Allendeite | 4.84 | |
| Allochalcoselite | 3.00 / 4.00 | 4.65 |
| Allophane | 3.00 / 3.00 | 1.90 |
| Alloriite | 5.00 / 5.00 | 2.35 |
| Alluaivite | 5.00 / 6.00 | 2.76 |
| Alluaudite | 5.00 / 5.50 | 3.45 |
| Almandine | 7.00 / 8.00 | 4.09 |
| Almarudite | 6.00 / 6.00 | 2.71 |
| Almeidaite | ||
| Alnaperbøeite-(Ce) | ||
| Alpersite | 2.50 / 2.50 | |
| Alsakharovite-Zn | 5.00 / 5.00 | 2.90 |
| Alstonite | 4.00 / 4.50 | 3.69 |
| Althausite | 3.50 / 3.50 | 2.97 |
| Althupite | 3.50 / 4.00 | 3.90 |
| Altisite | 6.00 / 6.00 | 2.64 |
| Alum-(K) | 2.00 / 2.00 | 1.76 |
| Alum-(Na) | 3.00 / 3.00 | 1.67 |
| Aluminite | 1.00 / 1.00 | 1.66 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se