Liste des éléments
»
Actinium
»
Argent
»
Argon
»
Arsenic
»
Astate
»
Azote
»
Baryum
»
Bismuth
»
Bohrium
»
Bore
»
Brome
»
Cadmium
»
Calcium
»
Carbone
»
Cérium
»
Césium
»
Chlore
»
Chrome
»
Cobalt
»
Cuivre
»
Curium
»
Dubnium
»
Erbium
»
Etain
»
Europium
»
Fer
»
Fermium
»
Fluor
»
Francium
»
Gallium
»
Hafnium
»
Hassium
»
Hélium
»
Holmium
»
Indium
»
Iode
»
Iridium
»
Krypton
»
Lanthane
»
Lithium
»
Lutécium
»
Mercure
»
Néodyme
»
Néon
»
Nickel
»
Nihonium
»
Niobium
»
Nobélium
»
Or
»
Osmium
»
Oxygène
»
Platine
»
Plomb
»
Polonium
»
Radium
»
Radon
»
Rhénium
»
Rhodium
»
Rubidium
»
Samarium
»
Scandium
»
Sélénium
»
Silicium
»
Sodium
»
Soufre
»
Tantale
»
Tellure
»
Tennesse
»
Terbium
»
Thallium
»
Thorium
»
Thulium
»
Titane
»
Uranium
»
Vanadium
»
Xénon
»
Yttrium
»
Zinc
Xe - Xénon - NON MÉTAL GAZ NOBLE
Le xénon est un élément chimique naturel, numéro atomique 54, de symbole Xe et de masse atomique 131,293. C'est un gaz noble inodore et incolore qui se trouve dans l'atmosphère terrestre en très faible concentration. Il est inerte chimiquement et stable à l'état normal.
Le xénon a une masse molaire de 131,3 g/mol et une pression de vapeur de 16,6 kPa à 25 °C. Il est plus lourd que l'air et à la pression atmosphérique, son point d'ébullition est de -111,8 °C. Il a un point de fusion de -108,1 °C et une densité relativement faible de 4,94 g/l à 25 °C.
Le xénon est largement utilisé pour ses propriétés réfrigérantes et lumineuses. Il est utilisé pour produire des lumières fluorescentes et pour des applications médicales telles que les scanners à rayons X ou les lasers à xénon. Il est également employé pour gonfler des pneus, pour produire des faisceaux à plasma et pour fabriquer des pompes à vide. Le xénon est également utilisé dans l'industrie automobile pour les phares et pour remplir les nouveaux réservoirs de carburant de véhicules. En outre, le xénon est employé dans la recherche scientifique pour étudier divers effets physiques et chimiques, tels que la diffusion des gaz et l'absorption des rayonnements.
Le xénon a une masse molaire de 131,3 g/mol et une pression de vapeur de 16,6 kPa à 25 °C. Il est plus lourd que l'air et à la pression atmosphérique, son point d'ébullition est de -111,8 °C. Il a un point de fusion de -108,1 °C et une densité relativement faible de 4,94 g/l à 25 °C.
Le xénon est largement utilisé pour ses propriétés réfrigérantes et lumineuses. Il est utilisé pour produire des lumières fluorescentes et pour des applications médicales telles que les scanners à rayons X ou les lasers à xénon. Il est également employé pour gonfler des pneus, pour produire des faisceaux à plasma et pour fabriquer des pompes à vide. Le xénon est également utilisé dans l'industrie automobile pour les phares et pour remplir les nouveaux réservoirs de carburant de véhicules. En outre, le xénon est employé dans la recherche scientifique pour étudier divers effets physiques et chimiques, tels que la diffusion des gaz et l'absorption des rayonnements.
Synthétique
Radioactif
Liquide
Gazeux
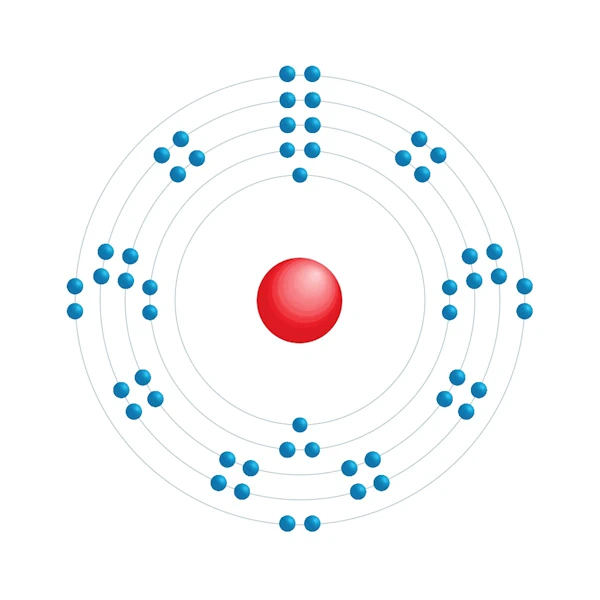
Diagramme de configuration électronique
| Nom | Xénon |
| Numéro atomique | 54 |
| Masse atomique | 131.293 |
| Symbole | Xe |
| Point de fusion | -111.9 |
| Point d'ébullition | -107 |
| Densité | 0.005887 |
| Période | 5 |
| Groupe | 18 |
| Découverte | 1898 Ramsay and Travers |
| Abondance | 0.001 |
| Radius | 1.2 |
| Electronégativité | 0 |
| Ionisation | 12.1298 |
| Nombre d'isotope | 31 |
| Configuration électronqiue | [Kr] 4d10 5s2 5p6 |
| Etats d'oxydation | 2,4,6,8 |
| Electron par niveau d'énergie | 2,8,18,18,8 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se