Liste des éléments
»
Actinium
»
Argent
»
Argon
»
Arsenic
»
Astate
»
Azote
»
Baryum
»
Bismuth
»
Bohrium
»
Bore
»
Brome
»
Cadmium
»
Calcium
»
Carbone
»
Cérium
»
Césium
»
Chlore
»
Chrome
»
Cobalt
»
Cuivre
»
Curium
»
Dubnium
»
Erbium
»
Etain
»
Europium
»
Fer
»
Fermium
»
Fluor
»
Francium
»
Gallium
»
Hafnium
»
Hassium
»
Hélium
»
Holmium
»
Indium
»
Iode
»
Iridium
»
Krypton
»
Lanthane
»
Lithium
»
Lutécium
»
Mercure
»
Néodyme
»
Néon
»
Nickel
»
Nihonium
»
Niobium
»
Nobélium
»
Or
»
Osmium
»
Oxygène
»
Platine
»
Plomb
»
Polonium
»
Radium
»
Radon
»
Rhénium
»
Rhodium
»
Rubidium
»
Samarium
»
Scandium
»
Sélénium
»
Silicium
»
Sodium
»
Soufre
»
Tantale
»
Tellure
»
Tennesse
»
Terbium
»
Thallium
»
Thorium
»
Thulium
»
Titane
»
Uranium
»
Vanadium
»
Xénon
»
Yttrium
»
Zinc
In - Indium - MÉTAL PAUVRE
L'indium est un élément chimique métallique appartenant au groupe 13 et à la période 5 du tableau périodique des éléments. De symbole atomique In et de numéro atomique 49, l'indium a 13 isotopes connus, de masse atomique variant entre 121 et 133. Il a un poids atomique relatif de 114,82.
L'indium a un point de fusion de 156,60 °C et un point d'ébullition de 2072 °C. Il a une densité relative de 7,29 g/cm3 et un état d'oxydation de +3. Sa couleur est blanc grisâtre lorsqu'il est pur, mais il prend une couleur rougeâtre lorsqu'il est chauffé.
L'indium est principalement utilisé pour créer des alliages pour des utilisations industrielles. Il peut être ajouté à l'acier pour le rendre plus corrosion-résistant. Il est également utilisé pour produire des alliages avec l'étain, ce qui est utile dans l'électronique et les appareils électroniques. En outre, l'indium joue également un rôle important dans la fabrication des composants électroniques.
Outre ces utilisations industrielles, l'indium est également utilisé pour produire des matériaux réfractaires pour l'isolation thermique. Il est également utilisé dans les cellules solaires et les capteurs. Enfin, il est utilisé pour produire des revêtements anti-adhérents pour les ustensiles de cuisine.
L'indium a un point de fusion de 156,60 °C et un point d'ébullition de 2072 °C. Il a une densité relative de 7,29 g/cm3 et un état d'oxydation de +3. Sa couleur est blanc grisâtre lorsqu'il est pur, mais il prend une couleur rougeâtre lorsqu'il est chauffé.
L'indium est principalement utilisé pour créer des alliages pour des utilisations industrielles. Il peut être ajouté à l'acier pour le rendre plus corrosion-résistant. Il est également utilisé pour produire des alliages avec l'étain, ce qui est utile dans l'électronique et les appareils électroniques. En outre, l'indium joue également un rôle important dans la fabrication des composants électroniques.
Outre ces utilisations industrielles, l'indium est également utilisé pour produire des matériaux réfractaires pour l'isolation thermique. Il est également utilisé dans les cellules solaires et les capteurs. Enfin, il est utilisé pour produire des revêtements anti-adhérents pour les ustensiles de cuisine.
Synthétique
Radioactif
Liquide
Gazeux
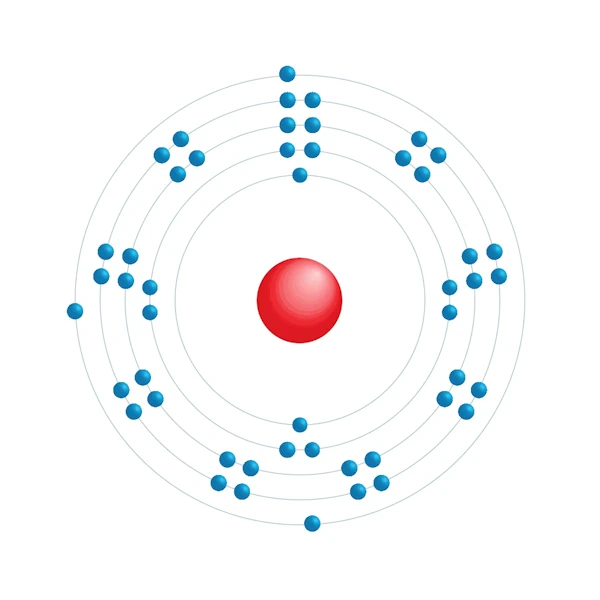
Diagramme de configuration électronique
| Nom | Indium |
| Numéro atomique | 49 |
| Masse atomique | 114.818 |
| Symbole | In |
| Point de fusion | 156.2 |
| Point d'ébullition | 2080 |
| Densité | 7.31 |
| Période | 5 |
| Groupe | 13 |
| Découverte | 1863 Reich and Richter |
| Abondance | 0.25 |
| Radius | 2 |
| Electronégativité | 1.78 |
| Ionisation | 5.7864 |
| Nombre d'isotope | 34 |
| Configuration électronqiue | [Kr] 4d10 5s2 5p1 |
| Etats d'oxydation | 1,2,3 |
| Electron par niveau d'énergie | 2,8,18,18,3 |
| Minéral | Dureté | Densité |
| Abramovite | ||
| Cadmoindite | ||
| Damiaoite | 5.00 / 5.00 | 10.95 |
| Dzhalindite | 4.00 / 4.50 | 4.34 |
| Indite | 5.00 / 5.00 | 4.67 |
| Indium | 3.50 / 3.50 | 7.20 |
| Ishiharaite | ||
| Kudriavite | 6.58 | |
| Laforêtite | 3.00 / 3.00 | 4.93 |
| Petrukite | 4.50 / 4.50 | 4.61 |
| Roquesite | 3.50 / 4.00 | 4.00 |
| Sakuraiite | 4.00 / 4.00 | 4.00 |
| Yanomamite | 5.50 / 6.00 | 3.87 |
| Yixunite | 6.00 / 6.00 | 18.21 |
| Znamenskyite |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se